Custo-efetividade da nutrição parenteral: como a glutamina pode influenciar nesse indicador?
A análise de custo-efetividade na nutrição parenteral (e de qualquer outra forma de suporte nutricional) passa por ponderar, além da mera questão financeira, a interferência da utilização da terapia na jornada do indivíduo submetido ao cuidado1.
Com isso em mente, que tal tirar uns minutos para entender melhor de que forma a introdução da glutamina pode influenciar desfechos importantes no seu paciente e quais os possíveis reflexos disso?
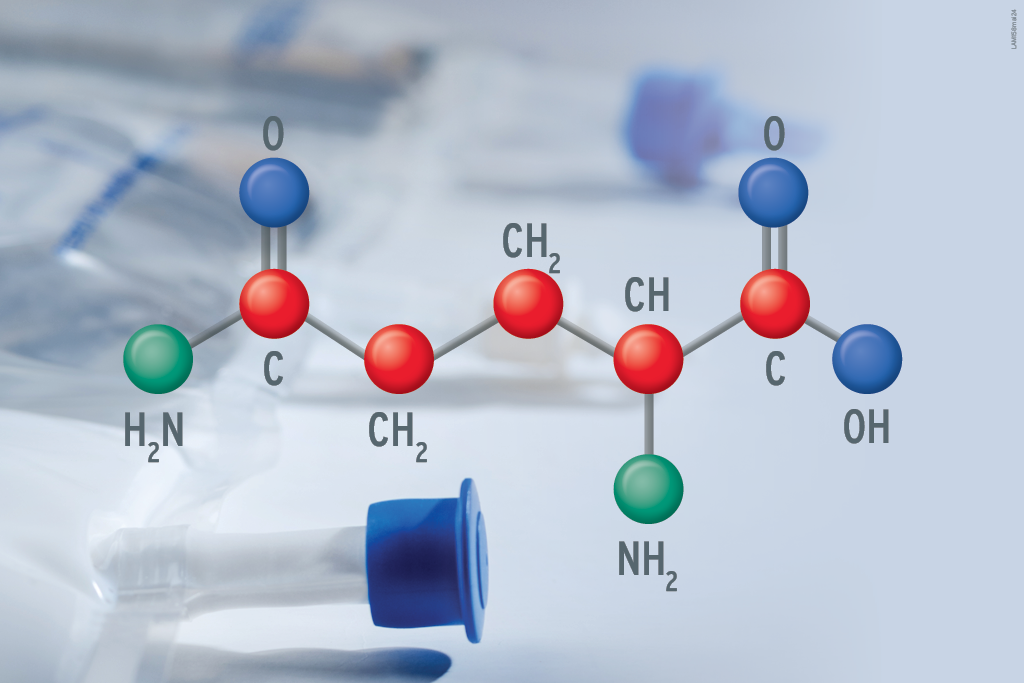
Para tanto, vamos recorrer aos dados de um artigo assinado por pesquisadores italianos com expertise no tema. Eles mostraram uma redução de custos totais de, em média, € 752 por paciente crítico com suporte de suplementação via parenteral com esse aminoácido na forma do dipeptídeo Ala-Gln, se comparada a uma fórmula padrão2.
Como o estudo foi feito?
A avaliação apresentada no artigo foi realizada baseada em um modelo de simulação farmacoeconômico que incorporou os seguintes aspectos: desfechos em amostras de pacientes críticos em estabelecimentos de saúde na Itália, dados de eficácia de metanálise comparando a glutamina (na forma do dipeptídeos alanil-glutamina) na nutrição parenteral versus a opção sem glutamina e, por último, dados de custos de internação4.
Os autores do estudo reforçam que há evidências que sustentam que a adição de Ala-Gln à nutrição parenteral pode ajudar a melhorar os resultados clínicos em pacientes críticos2. Entre os benefícios mais importantes estão a redução da mortalidade, do tempo de permanência no hospital e da taxa de infecções na unidade de terapia intensiva (UTI).
Nesse contexto, vale destacar que pacientes graves podem ter impacto maior sobre os custos hospitalares, pois os cuidados específicos direcionados a eles tendem a consumir boa parte dos recursos do hospital diante da necessidade maior de pessoal, de medicamentos (como antibióticos) e de equipamentos de suporte exclusivos de UTIs2.
Com isso em mente, os responsáveis pelo artigo utilizaram o modelo desenvolvido para projetar se o acréscimo da glutamina na nutrição parenteral poderia reduzir os custos dos estabelecimentos hospitalares. Na prática, isso poderia ampliar a eficiência do uso dos recursos disponíveis2.
Os autores, então, alimentaram o modelo tanto com o custo da nutrição parenteral convencional, quanto da suplementação com glutamina2. Para isso, foram levados em conta aspectos como o tempo de internação na UTI e após alta da UTI, dias de uso de nutrição parenteral e o peso dos pacientes2.
Eles incluíram também projeções das despesas com pacientes graves e possíveis complicações comuns nesses quadros, como infecções adquiridas na UTI.
Veja também: As vantagens no uso de diferentes aminoácidos na nutrição parenteral
Qual a influência da glutamina na custo-efetividade da nutrição parenteral?
Feita a simulação a partir do modelo proposto, foi possível concluir que, na média, a suplementação com glutamina poderia prevenir mais de um quarto dos casos de infecção e das mortes2. Adicionalmente, tal abordagem contribuiria para reduzir o tempo geral de permanência no ambiente hospitalar em 1,1 dias quando comparada com a terapia parenteral convencional2.
Assim, seria possível estimar que o uso da Ala-Gln reduziria os custos com a nutrição parenteral em até € 752 por paciente, conforme já mencionado. Ou seja, as despesas com a introdução da glutamina seriam amplamente compensadas pela economia nos custos de UTI (incluindo, também, a redução do uso de antibióticos)2.
Do ponto de vista clínico, nas mil simulações feitas usando o modelo, a nutrição parenteral com glutamina foi superior à opção sem essa suplementação, tomando como base de comparação o número de óbitos que seriam evitados2. Em menos de 1% dos casos, a inclusão da Ala-Gln impactou em um custo maior por paciente2.
Logo, os números reforçam a ideia de que a nutrição parenteral com Ala-Gln teria melhor custo-efetividade que as opções convencionais2. De um lado, os pacientes podem usufruir de melhores desfechos. De outro, os hospitais podem reduzir todos os custos associados ao manejo de doentes graves que precisam de uma UTI2.
Porém, os autores ainda reforçam que a introdução da Ala-Gln pode enfrentar alguns obstáculos. Entre eles estão o seu próprio custo de aquisição e a dificuldade em entender quem vai se beneficiar dela2. Entretanto, isso representa uma pequena fatia das variáveis nas despesas com a manutenção de um paciente grave. Ou seja, diante dos melhores desfechos clínicos alcançados, a custo-efetividade da nutrição parenteral com glutamina se mantém bastante favorável2.
E considerando a indicação da terapia com glutamina, aproveite agora para saber mais sobre os benefícios da glutamina no suporte ao paciente crítico.
Referências
- Correia MIT. A terapia nutricional é custo-efetiva? BRASPEN. Disponível em: <https://www.sbnpe.org.br/post/a-terapia-nutricional-%C3%A9-custo-efetiva> Acesso em 17 de março de 2024.
- Pradelli L, Iannazzo S, Zaniolo O, Muscaritoli M, Eandi M. Effectiveness and cost-effectiveness of supplemental glutamine dipeptide in total parenteral nutrition therapy for critically ill patients: a discrete event simulation model based on Italian data. Int J Technol Assess Health Care. 2012 Winter;28(1):22-28. Disponível em: <https://www.cambridge.org/core/journals/international-journal-of-technology-assessment-in-health-care/article/abs/effectiveness-and-costeffectiveness-of-supplemental-glutamine-dipeptide-in-total-parenteral-nutrition-therapy-for-critically-ill-patients-a-discrete-event-simulation-model-based-on-italian-data/F61727FD6BFBF677C95E64302F6F70F2> Acesso em 26 de fevereiro de 2024.
- Cai G, Yan J, Zhang Z, Yu Y. Immunomodulatory effects of glutamine-enriched nutritional support in elderly patients with severe sepsis: A prospective, randomized, controlled study. J Organ Dysfunct. 2008;4:31-37.
- Cavallo MC, Lazzaro C, Tabacchi M, et al. Cost of ICU in Italy. Results from an empirical study on a sample of 12 hospitals. Minerva Anestesiol. 2001;67:41-53.