O molibdênio e sua importância para a nutrição parenteral
Um oligoelemento conhecido há pouco tempo é o molibdênio. Apesar disso, ele é considerado um nutriente essencial por estar diretamente relacionado ao bom funcionamento de algumas proteínas que atuam em processos bioquímicos importantes do corpo humano, como veremos mais adiante.
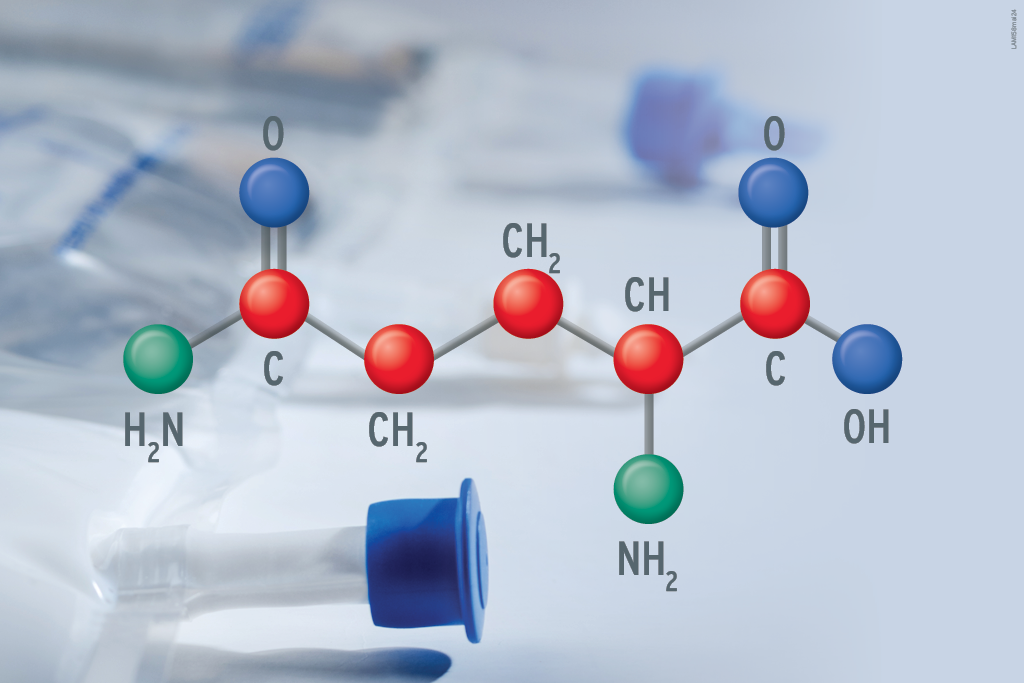
Esse mineral está presente na maioria das frutas e verduras, sendo naturalmente ingerido pelas pessoas que consomem alimentos in natura por via oral regularmente1. Pessoas que recebem alimentação por via intravenosa, entretanto, dependem de uma composição de macro e micronutrientes equilibrada. Por isso, há fórmulas dedicadas a pacientes em alimentação parenteral total que incluem o molibdênio em baixas doses.
Papel do molibdênio
Mesmo hoje sendo considerado um elemento traço, a importância do moibdênio só foi evidenciada na década de 1950. Ele passou a ser considerado um oligoelemento essencial quando se descobriu que participava de processos importantes do metabolismo humano.2
Normalmente, o molibdênio encontra-se ligado a proteínas tanto no sangue quanto em tecidos1. As maiores concentrações do mineral são encontradas no fígado, nos rins e na glândula suprarrenal, e as menores, na pele, no esôfago, na traqueia, na aorta, no útero e na bexiga2.
Sabe-se que o molibdênio atua como cofator de pelo menos quatro enzimas.2 Confira a seguir:
Sulfito oxidase
A sulfito oxidase catalisa a reação terminal na degradação dos aminoácidos sulfurados. A deficiência genética da sulfito oxidase resulta em anormalidades neurológicas e frequentemente leva à morte em idade precoce.2,3
Xantina oxidase
A xantina oxidase catalisa a oxidação de purinas em ácido úrico.2 Ela está presente no leite e em muitos outros tecidos e vem sendo estudada há mais de 100 anos, sendo que sua complexidade estrutural e distribuição de tecidos especializados sugerem outras funções que nunca foram totalmente identificadas, como a capacidade de gerar espécies reativas de oxigênio e óxido nítrico.4
Aldeído oxidase
A aldeído oxidase está envolvida no metabolismo de vários compostos N-heterocíclicos endógenos e exógenos de importância farmacológica e toxicológica. Essa enzima é o produto de um gene que está implicado na etiopatogênese da esclerose lateral amiotrófica recessiva familiar.5
Amidoxima mitocondrial
O componente redutor de amidoxima mitocondrial (mARC) foi descoberto recentemente. Está presente de forma abundante no fígado e nos rins e acredita-se que partcipa da desintoxicação de substratos N-hidroxilados.2
Deficiência de molibdênio
Como vimos, o molibdênio é necessário para diversas funções do organismo. A eventual falta desse nutriente pode levar ao prejuízo da atividade das enzimas que dependem desse metal como cofator6.
A deficiência de molibdênio, no entanto, é rara, já que ele está presente em diversos alimentos. Porém, ela já foi observada em paciente submetido à nutrição parenteral total prolongada para o tratamento de doença de Crohn, que apresentou sinais clínicos como irritabilidade, taquicardia, taquipneia (respiração acelerada) e cegueira noturna.7
Os sintomas da deficiência no mineral podem ocorrer com maior frequência em bebês. Nesse caso, eles apresentam uma anomalia genética que os impede de sintetizar o molibdênio, levando à falta da enzima sulfito oxidase. Como consequência, podem surgir danos neurológicos graves, convulsões e morte dos recém-nascidos poucos dias após o parto.6
Leia também: O que é desnutrição relacionada a doença?
Gostou desse artigo? Leia mais sobre Nutrição Parenteral aqui.
Referências
- Institute of Medicine. Food and Nutrition Board. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington, DC: National Academy Press; 2001. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK222301/
- Novotny JA. Molybdenum nutriture in humans. J Evid Based Compl Alter Med 2011;16(3):164-8. Disponível em: https://journals.sagepub.com/doi/full/10.1177/2156587211406732
- GARRET, R.M. et al. Human sulfite oxidase R160Q: identification of the mutation in a sulfite oxidase-deficient patient and expression and characterization of the mutant enzyme. Proc Natl Acad Sci USA. 1998;95(11):6394-8. Disponível em: https://pubmed.ncbi.nlm.nih.gov/9600976/
- HARRISON, R. Structure and function of xanthine oxidoreductase: where are we now? Free Radic Biol Med. 2002;33(6):774-97. Disponível em: https://pubmed.ncbi.nlm.nih.gov/12208366/
- TERAO, M. et al. Isolation and characterization of the human aldehyde oxidase gene: Conservation of intron/exon boundaries with the xanthine oxidoreductase gene indicates a common origin. Biochemical Journal 1998;332 ( Pt 2)(Pt 2):383-93. Disponível em: https://www.researchgate.net/publication/13683259_Isolation_and_characterization_of_the_human_aldehyde_oxidase_gene_Conservation_of_intronexon_boundaries_with_the_xanthine_oxidoreductase_gene_indicates_a_common_origin
- Arnold GL, Greene CL, Stout JP, Goodman SI. Molybdenum cofactor deficiency. J Pediatr 1993;123(4):595-8. Disponível em: https://www.jpeds.com/article/S0022-3476(05)80961-8/pdf
- Abumrad NN. Amino acid intolerance during prolonged total parenteral nutrition reversed by molybdenum therapy. Am J Clin Nutr 1981;34(11):2551-9. Disponível em: https://academic.oup.com/ajcn/article-abstract/34/11/2551/4692819?redirectedFrom=fulltext