Vantagens no uso de diferentes aminoácidos na nutrição parenteral
O fornecimento de aminoácidos na nutrição parenteral é um dos fatores mais importantes no suporte nutricional. Nesse sentido, existem diversos tipos de aminoácidos, que exercem funções específicas no organismo.
A seguir, vamos entender como eles se dividem e como podem ser usados para as diferentes necessidades dos pacientes que precisam de nutrição parenteral.
Papel dos aminoácidos no organismo
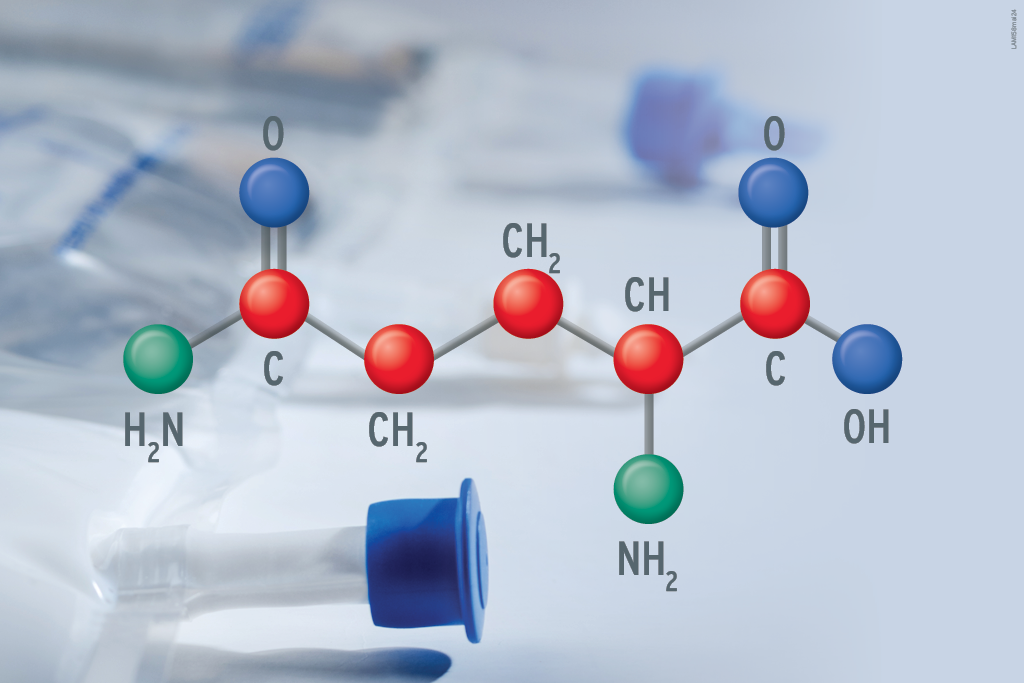
Os aminoácidos são as unidades estruturais das proteínas, que sustentam processos químicos vitais.
Entre as funções que eles desempenham no organismo, podemos destacar (1):
- Construção de músculos, órgãos, glândulas, ligamentos, tendões, unhas, cabelos e ossos;
- Hormônios e enzimas;
- Regulação de vias metabólicas fundamentais para a imunidade, reprodução, manutenção e crescimento (papel exercido pelos aminoácidos funcionais: arginina, cisteína, glutamina, leucina, prolina e triptofano);
- Única fonte de nitrogênio;
- Preservação da estrutura celular, cicatrização de feridas, herança enzimática e hormonal, já que não temos estoque no organismo e dependemos das proteínas externas em quantidade e qualidade para compensar as perdas diárias.
Os aminoácidos se dividem entre (2):
- Aminoácidos essenciais: não são sintetizados pelo organismo e, portanto, precisam ser consumidos.
- Aminoácidos não essenciais: são sintetizados a partir de moléculas de carboidratos intracelulares e grupos amina.
- Aminoácidos semi-essenciais ou condicionalmente essenciais: podem ser sintetizados a partir de outros aminoácidos em certas circunstâncias, mas sua síntese é limitada.
Papel dos aminoácidos na nutrição parenteral
A deficiência de proteína e energia é comum em pacientes hospitalizados e naqueles que apresentam estado crítico.
Além disso, muitas doenças e tratamentos alargam significativamente as necessidades de proteína do organismo ou provocam um aumento patológico do catabolismo (consumo) de proteínas musculares. São exemplos de situações em que isso ocorre a terapia com altas doses de glicocorticoides e a resposta inflamatória sistêmica à sepse e a grandes traumas (3).
Como consequência desses quadros, pacientes hospitalizados podem sofrer atrofia muscular generalizada. Essa alteração é debilitante, difícil de reverter e representa uma ameaça à vida (3).
Assim, a nutrição parenteral busca oferecer quantidades significativas, mas não tóxicas, de proteínas, sendo ferramenta importante no alcance desse objetivo (3).
Nos pacientes em nutrição parenteral, a ingestão de proteínas é atendida pelo fornecimento de soluções estéreis intravenosas de aminoácidos livres. As soluções padrão contêm aminoácidos essenciais, alguns aminoácidos não essenciais e, ocasionalmente alguns aminoácidos semi-essenciais (1).
Essa composição busca fornecer ao organismo os elementos necessários para o balanço energético e proteico, além de atingir a quantidade necessária de nitrogênio (1).
Em situações clínicas específicas (ex.: erro no metabolismo de algum aminoácido), recém- nascidos prematuros e pacientes críticos, soluções especializadas podem ser necessárias (4).
Aminoácidos de destaque
O aumento de massa muscular esquelética requer uma quantidade efetiva de aminoácidos essenciais, principalmente leucina, isoleucina e metionina, que, em dose adequada, desencadeiam uma resposta anabólica e, portanto, o crescimento muscular (1).
Entre os aminoácidos não essenciais, parece que a contribuição específica de cada um desses aminoácidos nas formulações parenterais é menos importante que a quantidade total de nitrogênio que, juntos, eles fornecem (3).
Alguns aminoácidos se destacam por seu papel na nutrição dos pacientes que dependem da terapia parenteral. Confira a seguir.
Tirosina
A tirosina se torna essencial para órgãos e tecidos que não possuem a fenilalanina hidroxilase, enzima que converte a fenilalanina em tirosina. Assim, a adição de tirosina a outros aminoácidos essenciais melhoraria a eficácia de sua síntese (1).
A concentração de tirosina em misturas de aminoácidos é limitada por sua baixa solubilidade, porém, como colocado anteriormente, ela pode ser sintetizada a partir da fenilalanina.
Se a oferta de fenilalanina for suficiente e o paciente que estiver com balanço nitrogenado neutro ou negativo e com a conversão de fenilalanina em tirosina desimpedida, a necessidade de tirosina será atendida apenas pela fenilalanina (3).
Cisteína
A cisteína é um aminoácido importante na síntese de proteínas e taurina, bem como para a síntese de glutationa. A glutationa é uma pedra angular na manutenção do equilíbrio oxidante-antioxidante em bebês prematuros que são expostos a alto estresse oxidativo induzido principalmente por suplementação de O2 e NP contaminada com peróxido (5).
A cisteína é um aminoácido não essencial em condições normais, mas se torna um aminoácido essencial em circunstâncias específicas, como prematuridade e sob estresse oxidativo (5).
Em bebês prematuros, alguns estudos mostraram que a suplementação parenteral de cisteína pode não melhorar o crescimento neonatal nem reduzir doenças, devido à imaturidade na captação celular de cisteína. Como alternativa, a glutationa oxidada (GSSG) pode atuar como um reservatório de cisteína (5).
Taurina
Embora não faça parte de nenhuma proteína, a taurina é amplamente distribuída no corpo e é o aminoácido livre mais abundante no leite materno humano. Alta concentração de taurina é encontrada no cérebro, retina madura e ouvido interno (6).
Nos tecidos neurais, a taurina funciona como um osmólito orgânico intracelular, regulando assim o volume da célula neural. Ao modular a homeostase do cálcio intracelular, tem efeito estabilizador da membrana. A taurina também tem efeito citoprotetor contra danos oxidativos e excitotoxicidade induzida por glutamato (6).
Os recém-nascidos prematuros são mais vulneráveis à deficiência de taurina devido à baixa capacidade de síntese endógena e maior perda renal (6).
Assim, segundo a Sociedade Europeia de Nutrição Clínica e Metabolismo (2), apesar de não se tratar de um aminoácido típico, a taurina deve fazer parte das soluções de aminoácidos para lactentes e crianças em nutrição parenteral.
Arginina
L-arginina é o aminoácido mais rico em nitrogênio, atuando como um precursor essencial para a síntese de metabólitos contendo nitrogênio e um intermediário essencial na depuração do excesso de nitrogênio. Suas propriedades incluem um papel primário na excreção de nitrogênio, sinalização celular e tamponamento de energia (7).
A suplementação de arginina pode ser usada em recém-nascidos prematuros, pois ela contribui para a vasodilatação e a homeostase da glicose e ajuda a prevenir a enterocolite necrosante. Além disso, a arginina pode estar relacionada à imunidade desses bebês (2, 8).
Em seu consenso sobre o uso de proteína em pacientes críticos, a Associação Colombiana de Nutrição Clínica (ACNC) e de Medicina Crítica e Terapia Intensiva (AMCI) (10) sugeriu que uso de aminoácidos suplementares (arginina e seus precursores glutamina e citrulina) é indicado quando houver confirmação de deficiência. Estes casos incluem, por exemplo:
- Paciente submetido a cirurgia eletiva de grande porte (principalmente em cirurgia eletiva para câncer gastrointestinal);
- Paciente com anemia de células falciformes e crises de anemia hemolítica;
- Paciente submetido a quimioterapia/radioterapia para câncer de cabeça e pescoço.
Além disso, a suplementação deste aminoácido parece promissora nos seguintes casos:
- Paciente com trauma múltiplo;
- Paciente com queimaduras (abrangendo mais de 25% da superfície corporal total);
- Paciente submetido a cirurgia reconstrutiva (com retalhos pediculados ou retalhos revascularizados).
Glutamina
Quando utilizada pela via parenteral, nas concentrações de 0,3 a 0,5 g/kg/ dia e, no máximo, de 30% do nitrogênio total prescrito, a glutamina reduz a incidência de complicações infecciosas, tempos de internação na UTI e no hospital, tempo de ventilação mecânica e taxa de mortalidade hospitalar (11).
Em uma pesquisa que analisou a suplementação parenteral com GLN em pacientes cirúrgicos críticos com base em sete ensaios clínicos randomizados (ECRs), as infecções foram significativamente reduzidas. Além disso, o tempo de internação hospitalar foi 4,09 dias menor (12).
Entretanto, o uso parenteral de glutamina está contraindicado em pacientes com disfunção orgânica múltipla, disfunção renal, disfunção hepática ou instabilidade hemodinâmica (13).
O que podemos concluir?
Em resumo, a utilização de diferentes aminoácidos na nutrição parenteral apresenta vantagens significativas para o suporte e recuperação dos pacientes. A composição adequada é crucial para manter o equilíbrio energético e proteico, assegurando a construção e manutenção de tecidos, a síntese de hormônios e enzimas, além de contribuir para a resposta imunológica e a homeostase metabólica.
Cada aminoácido exerce funções específicas que podem ser adaptadas conforme as necessidades clínicas individuais, proporcionando suporte anabólico, proteção antioxidante, controle do catabolismo e reparo tecidual.
Assim, a nutrição parenteral bem formulada torna-se uma ferramenta indispensável para minimizar complicações, promover a recuperação e melhorar os desfechos clínicos, especialmente em contextos de estado crítico e necessidades nutricionais elevadas.
Referências
- Iacone R, Scanzano C, Santarpia L, Cioffi I, Contaldo F, Pasanisi F. Macronutrients in parenteral nutrition: amino acids. Nutrients. 2020;12(3):772.
- van Goudoever JB, et al. ESPGHAN/ESPEN/ESPR guidelines on pediatric parenteral nutrition: Amino acids. European Society for Clinical Nutrition and Metabolism. 2018.
- Hoffer LJ. Parenteral Nutrition: Amino Acids. Nutrients. 2017;9(3):257.
- Yarandi SS, Zhao VM, Hebbar G, Ziegler TR. Amino Acid Composition in Parenteral Nutrition: What is the Evidence? Curr Opin Clin Nutr Metab Care. 2011;14(1):75-82.
- Mohamed I, El Raichani N, Otis AS, Lavoie JC. Parenteral Cysteine Supplementation in Preterm Infants: One Size Does Not Fit All. Biomedicines. 2023 Dec 27;12(1):63.
- Chawla D. Taurine and Neonatal Nutrition. Indian J Pediatr. 2018;85(10):829.
- Fung TS, Ryu KW, Thompson CB. Arginine: at the crossroads of nitrogen metabolism. EMBO J. 2025 Mar;44(5):1275-1293.
- Badurdeen S, Mulongo M, Berkley JA. Arginine depletion increases susceptibility to serious infections in preterm newborns. Pediatr Res. 2015;77(2):290-297..
- Trejos-Gallego D, Peternina FP, Cano AP, Barbosa JB, Gautier JBO, Waitzberg D, Ricardo VCN. Consenso sobre el uso de proteína en el paciente crítico–ACNC. Revista de Nutrición Clínica y Metabolismo. 2023;6(2):11-34.
- Stehle P, Ellger B, Kojic D, Feuersenger A, Schneid C, Stover J, et al. Glutamine dipeptide-supplemented parenteral nutrition improves the clinical outcomes of critically ill patients: a systematic evaluation of randomised controlled trials. Clin Nutr ESPEN. 2017;17:75-85.
- Pimentel RFW, Fernandes SL. Effects of parenteral glutamine in critically ill surgical patients: a systematic review and meta-analysis. Nutr Hosp. 2020 Jul 13;34(3):616-621.
- Castro MG, et al. Diretriz Brasileira de Terapia Nutricional no Paciente Grave. BRASPEN J. 2018;33(Supl 1):2-36.