Emulsões Lipídicas Parenterais: Tudo que Você Precisa Saber
Os lipídios foram uma adição tardia de macronutrientes à formulação de nutrição parenteral (NP) na década de 1960. A experimentação ao longo dos anos levou a uma ampla gama de emulsões lipídicas parenterais, com variáveis fontes de gordura e efeitos para o paciente nos dias atuais (1).
Hoje, você irá descobrir o que são as emulsões lipídicas parenterais, suas gerações, recomendações práticas para o seu uso, e muito mais. Confira a seguir!
O que são as emulsões lipídicas?
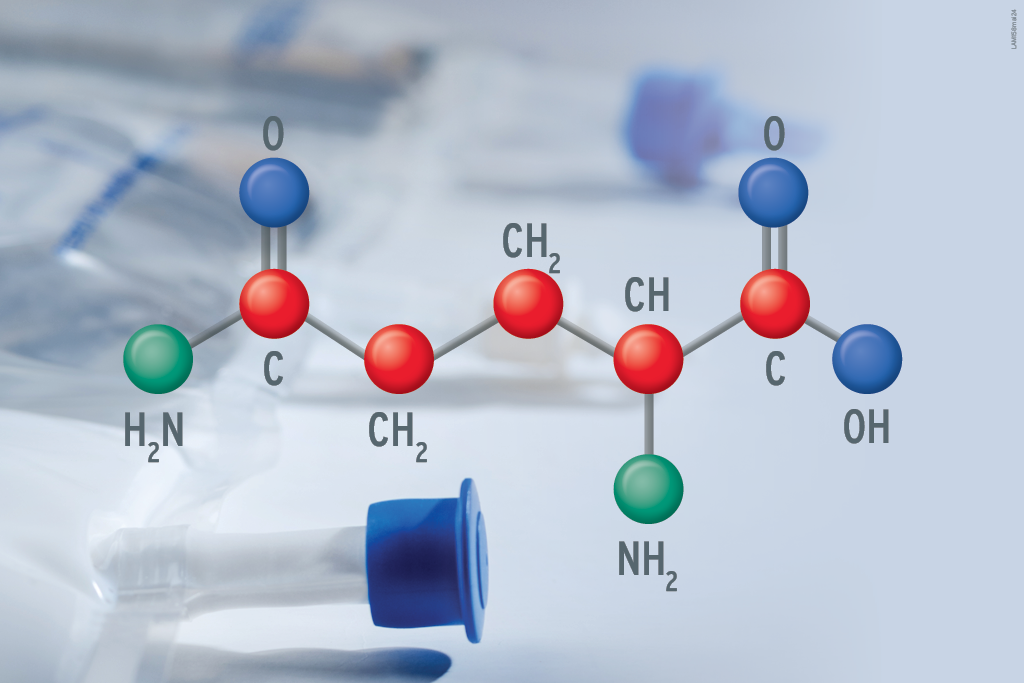
Emulsões lipídicas (EL) são formulações complexas, que fornecem cerca de 25 a 40% de energia não proteica para a nutrição parenteral; previnem a deficiência de ácidos graxos essenciais; e podem ter propriedades anti-inflamatórias ou imunomoduladoras (2, 3).
As ELs são misturas de óleo em água, uma combinação aceitável graças ao uso de um agente emulsificante apropriado (3, 4).
Suas fontes de gordura variam entre as formulações, incluindo óleo de soja, óleo de oliva, óleo de peixe e óleo de coco. Essas diferenças resultam em proporções variadas de ômegas 3, 6 e 9, fosfolipídios e triglicérides de cadeia média (TCM) que terão diferentes comportamentos em função de potencial oxidativo, inflamatório e imunossupressivo (5).
Por conterem uma alta densidade energética, as emulsões lipídicas possibilitam reduzir o fornecimento de glicose na NP, evitando os riscos de hiperglicemia e insuficiência hepática (5, 6).
Emulsões lipídicas: componentes oleicos e ácidos graxos
As diferentes fontes de gordura presente nas emulsões lipídicas determinam seu teor de ácidos graxos. Como sabemos, de acordo com o comprimento da cadeia de carbonos, os ácidos graxos podem ser (1):
- AGs de cadeia curta: 4 átomos de carbono ou menos
- AGs de cadeia média: 6 a 14 átomos de carbono
- AGs de cadeia longa: acima de 14 átomos de carbono
Além disso, os ácidos graxos também podem ser classificados pela presença ou ausência de saturação entre as ligações de carbono (1).
Desse modo, os triglicerídeos presentes nas ELs podem ser constituídos de AGs poli-insaturados de cadeia longa (ácido linolênico e ácido linoleico); de AGs monoinsaturados de cadeia longa (ácido oleico); e de AGs saturados de cadeia média (7).
As concentrações desses ácidos nas ELs qualificam-se de acordo com os anos de lançamento no mercado (1, 3, 7):
| Geração | Composição | Considerações |
| Primeira Geração (1960) | 100% óleo de soja | – Fonte de AGs essenciais e energia
– Rico em ω-6 |
| Segunda Geração (1980) | Inclusão de TCM:
50% óleo de soja + 50% óleo de coco
|
– Fonte de AGs essenciais e energia
– Teor de ω-6 reduzido, diminuindo impacto inflamatório — Produto mais estável |
| Terceira Geração (1990) | 75 a 80% de azeite de oliva + 20 a 25% de óleo de soja | – Fonte de AGs essenciais e energia
– Redução ainda maior de ω-6 – Redução parcial do impacto inflamatório, imunológico e da coagulação devido inclusão de ω-9 |
| Quarta Geração (2000) | Mistura de óleo de soja, óleo de oliva, óleo de coco e óleo de peixe em diferentes proporções;
OU apenas óleo de peixe |
– Fonte de AGs essenciais e energia
– Fonte de ω-3 (EPA e DHA) – Equilíbrio entre ω-3 e ω-6 – Ação imunomoduladora, essenciais para pacientes críticos – Potencial de reverter a doença hepática associada à insuficiência intestinal (IFALD) |
Outros componentes das emulsões lipídicas
Embora os principais componentes das emulsões lipídicas sejam os ácidos graxos, outros componentes também estão presentes, com características funcionais que precisam ser consideradas de acordo com o perfil e estado de cada paciente (1).
Fitoesteróis
Os fitoesteróis são compostos vegetais estruturalmente semelhantes ao colesterol. Normalmente, menos de 5% dos fitoesteróis são absorvidos, mas em crianças recebendo NP, ocorre uma absorção de 100%, podendo levar ao acúmulo de sais biliares no fígado, um marcador de colestase hepática (1).
A colestase surgiu como um problema com o uso a longo prazo de emulsões lipídicas com óleo de oliva em bebês (8) ou óleo de soja em crianças (9).
Alfa-tocopherol
A principal forma de vitamina E em ELs é o α-tocoferol, adicionado para prevenir a peroxidação lipídica em lipídios ricos em ácidos graxos poli-insaturados (1).
Estudos sugerem que aumentar a concentração de α-tocoferol pode melhorar a estabilidade das ELs e reduzir marcadores de lesão hepática. Emulsões à base de óleo de peixe são naturalmente ricas nesse nutriente, enquanto óleos de soja e cártamo são mais ricos em outra forma de tocoferol, menos protetora (1).
Emulsificantes
As ELs são emulsões de óleo em água estabilizadas por fosfolipídios, principalmente derivados de óleo de soja e gema de ovo (1).
Entretanto, um excesso de emulsificante pode levar à formação de lipossomas, que podem interferir no metabolismo lipídico e contribuir para a hiperlipidemia e acúmulo de colesterol. O impacto dos lipossomas na circulação depende da concentração de óleo na emulsão, taxa e duração da infusão (1).
Vitamina K
A filoquinona (vitamina K1) é essencial para a coagulação sanguínea, e sua deficiência prolonga o tempo de coagulação. As recomendações dietéticas variam, sendo de 1 μg/kg para adultos (1).
Em pacientes em terapia anticoagulante, o teor de vitamina K nas ELs deve ser considerado, pois óleos usados na formulação contêm diferentes quantidades: óleo de soja (150–300 μg/100 g), óleo de oliva (1.1–5.5 μg/100 g) e óleo de cártamo (6–12 μg/100 g) (1).
Como escolher a emulsão lipídica?
Pacientes estáveis
O óleo de soja é a opção mais barata entre as fontes de lipídeos e funciona bem para pacientes estáveis, pois é uma excelente fonte de calorias não proteicas e oferece potencialmente bom conteúdo de ácidos graxos essenciais (5).
No entanto, é importante considerar alguns fatores. Ele possui uma alta concentração de ácidos graxos de cadeia longa, como o ácido linoleico, associado a efeitos pró-inflamatórios e imunossupressores (3, 10, 11).
Essa característica, juntamente ao seu alto teor de fitoesterois, pode contribuir para uma série de complicações, como doença hepática associada à falência intestinal e hipertrigliceridemia, além de impactar o sistema imunológico (11, 12, 13, 14).
Pacientes hipermetabólicos e críticos
O estresse metabólico é um desafio frequente na prática clínica. A substituição de um terço das calorias de formulações de nutrição parenteral baseadas em glicose e aminoácido por uma emulsão lipídica já é uma medida importante para atingir um estado anabólico e foi associada com redução das complicações metabólicas hepática e relacionadas à glicose (15, 16, 17).
No entanto, estudos mais recentes vêm demonstrando também que as formulações baseadas exclusivamente em óleo de soja devem ser evitadas em pacientes hipermetabólicos (5, 18).
Deve-se dar preferência a emulsões lipídicas que contenham triglicerídeos de cadeia média, óleo de oliva e óleo de peixe. Fazendo essa troca, busca-se diminuir o fornecimento de ácidos graxos ômega 6, mais potencialmente oxidativos, inflamatórios, imunossupressores e pró-trombóticos (5, 18).
No caso de pacientes criticamente enfermos, a Sociedade Brasileira de Nutrição Parenteral e Enteral (BRASPEN) também não recomenda a utilização de emulsões lipídicas baseadas exclusivamente em óleo de soja (19).
Indica-se dar preferência às emulsões lipídicas que contenham óleo de peixe, boas fontes de ácidos eicosapentaenóico e docosahexaenóico, que modulam a resposta imunológica e, provavelmente, reduzem a permanência na unidade de terapia intensiva (5).
Emulsões lipídicas: recomendações práticas
Quando iniciar a infusão de emulsão lipídica?
Quando a nutrição parenteral é indicada, a emulsão lipídica deve ser infundida como parte da NP (5).
Infusão de emulsões lipídicas
Na administração de ELs, o tempo máximo de infusão deve ser de até 24 horas (3, 4, 7).
Entretanto, ao utilizar ELs reembalados, por exemplo, transferidos para seringas ou outras bolsas, a duração da infusão não deve exceder 12 horas para minimizar o risco de contaminação (3, 4).
Qual é a dose recomendada?
As doses diárias de emulsão lipídica para adultos, sugeridas pela Sociedade Americana de Nutrição Parenteral e Enteral (ASPEN), são fornecidas na tabela abaixo (3).
| Emulsão lipídica à base de óleo de soja | Emulsão lipídica com óleo de soja, TCM, azeite de oliva e óleo de peixe | Emulsão lipídica à base de azeite de oliva e óleo de soja |
| Paciente criticamente doente: <1 g/kg/d
Paciente estável: 1 g/kg/d
Não exceder 1,5 g/kg/d |
1 a 1,5 g/kg/d
Não exceder 1,5 g/kg/d
|
1–1,5 g/kg/d
Não exceder 1,5 g/kg/d
|
Monitoramento
Como em qualquer intervenção terapêutica, as emulsões lipídicas têm o potencial de causar efeitos adversos, alguns dos quais são relacionados à dose ou à taxa de infusão e podem ser evitados (3).
Os efeitos adversos incluem síndrome de sobrecarga de gordura, hipercoagulação, interferência na função imunológica, efeitos hepáticos negativos, comprometimento pulmonar, risco de infecção, hipertrigliceridemia e pancreatite (3).
Desse modo, o monitoramento de pacientes inclui – mas não está limitado a – checar concentrações séricas de triglicerídeos basais e semanais e testes de função hepática durante a hospitalização. Os níveis de TG também devem ser verificados quando a dose de ELs muda (3).
Para pacientes adultos que necessitam de terapia NP de longo prazo (> 1 mês), os níveis de TG devem ser obtidos pelo menos uma vez por mês. A frequência de monitoramento pode ser ajustada com base no estado clínico de cada paciente (3).
Conclusão
Em resumo, as emulsões lipídicas são componentes essenciais da nutrição parenteral, fornecendo energia e ácidos graxos essenciais. A escolha da formulação e o monitoramento adequado são fundamentais para garantir a segurança e a eficácia do tratamento.
Afinal, na terapia nutricional, cada detalhe conta para a recuperação e qualidade de vida do paciente.
Referências:
- Sadu Singh BK, Narayanan SS, Khor BH, Sahathevan S, Abdul Gafor AH, Fiaccadori E, Sundram K, Karupaiah T. Composition and Functionality of Lipid Emulsions in Parenteral Nutrition: Examining Evidence in Clinical Applications. Front Pharmacol. 2020 Apr 29;11:506. Erratum in: Front Pharmacol. 2021 Apr 16;12:663960.
- Kisioglu B, Tamer F. Impact of lipid emulsions in parenteral nutrition on platelets: a literature review. Journal of Nutritional Science. 2024;13:e18.
- Mirtallo JM, Ayers P, Boullata J, Gura KM, Plogsted S, Anderson CR, Worthington P, Seres DS, Nicolai E, Alsharhan M, Gutsul L, Mason AE. ASPEN Lipid Injectable Emulsion Safety Recommendations, Part 1: Background and Adult Considerations. Nutr Clin Pract. 2020 Oct;35(5):769-782. Epub 2020 May 27. Erratum in: Nutr Clin Pract. 2022 Apr;37(2):482.
- Boullata JI, Berlana D, Pietka M, Klek S, Martindale R. Use of Intravenous Lipid Emulsions With Parenteral Nutrition: Practical Handling Aspects. JPEN J Parenter Enteral Nutr. 2020 Feb;44 Suppl 1:S74-S81.
- Calder PC, Waitzberg DL, Koletzko B (eds): Intravenous Lipid Emulsions. The Complexity of Prescribing Intravenous Lipid Emulsions. World Rev Nutr Diet. Basel, Karger, 2015, vol 112, pp 150–162.
- Calder PC, Jensen GL, Koletzko BV, et al: Lipid emulsions in parenteral nutrition of intensive care patients: Current thinking and future directions. Intensive Care Med 2010;36:735–749.
- Castro MG, Torrinhas R, Waitzberg DL, da Silva MDLT, de Aguilar Nascimento JE, Alves JTM, Antunes MS, Costa GC, Feferbaum R, Machado JZ, Matos LBN de, Miola TM, Pinto LM, Portari Filho PE, Correia MITD. Posicionamento BRASPEN sobre o uso clínico de ômega 3 via parenteral. Braspen J. 2023;37(2):199-138.
- Savini S, D’Ascenzo R, Biagetti C, Serpentini G, Pompilio A, Bartoli A, Cogo PE, Carnielli VP. The effect of 5 intravenous lipid emulsions on plasma phytosterols in preterm infants receiving parenteral nutrition: a randomized clinical trial. Am J Clin Nutr. 2013 Aug;98(2):312-8.
- Clayton PT, Bowron A, Mills KA, Massoud A, Casteels M, Milla PJ. Phytosterolemia in children with parenteral nutrition-associated cholestatic liver disease. 1993 Dec;105(6):1806-13.
- Mundi MS, Salonen BR, Bonnes S. Home parenteral nutrition: fat emulsions and potential complications. Nutr Clin Pract. 2016;31(5):629-641.
- Mundi MS, Martindale R, Hurt RT. Emergence of Mixed-Oil Fat Emulsions for Use in Parenteral Nutrition. JPEN J Parenter Enteral Nutr. 2017;41(1_suppl):3S-13S
- Meguid MM, Kurzer M, Hayashi RJ, Akahoshi MP. Short-term effects of fat emulsion on serum lipids in postoperative patients. JPEN J Parenter Enteral Nutr. 1989;13(1):77-80
- Seidner DL, Mascioli EA, Istfan NW, et al. Effects of long-chain triglyceride emulsions on reticuloendothelial system function in humans. JPEN J Parenter Enteral Nutr. 1989;13(6):614-619.
- Cavicchi M, Beau P, Crenn P, Degott C, Messing B. Prevalence of liver disease and contributing factors in patients receiving home parenteral nutrition for permanent intestinal failure. Ann Intern Med. 2000;132(7):525-532.
- Meguid MM, Schimmel E, Johnson WC, et al: Reduced metabolic complications in total parenteral nutrition: pilot study using fat to replace one-third of glucose calories. JPEN J Parenter Enteral Nutr 1982; 6:304–307.
- Meguid MM, Akahoshi MP, Jeffers S, et al: Amelioration of metabolic complications of conventional total parenteral nutrition. A prospective randomized study. Arch Surg 1984;119:1294–1298
- Paluzzi M, Meguid MM. A prospective randomized study of the optimal source of nonprotein calories in total parenteral nutrition. Surgery 1987;102:711– 717.
- Waitzberg DL, Torrinhas RS, Jacintho TM: New parenteral lipid emulsions for clinical use. JPEN J Parenter Enteral Nutr 2006;30:351–367.
- Castro MG, Torrinhas R, Waitzberg DL, da Silva MDLT, de Aguilar Nascimento JE, Alves JTM, et al. Posicionamento BRASPEN sobre o uso clínico de ômega 3 via parenteral. Braspen J. 2023;37(2):199-138.