Nutrição parenteral em adultos: quais são as recomendações de macronutrientes?
A nutrição parenteral (NP), desenvolvida na década de 1960, é uma terapia intravenosa essencial para pacientes que não conseguem absorver adequadamente os nutrientes pelo trato gastrointestinal, fornecendo nutrição de forma completa (1, 2).
As fórmulas de NP são soluções extremamente complexas, combinando aminoácidos, dextrose, emulsão lipídica, eletrólitos, oligoelementos, vitaminas e, ocasionalmente, medicamentos. Por esse motivo, cada fórmula deve ser cuidadosamente balanceada de acordo com a condição metabólica do paciente, considerando o estado da doença, o metabolismo, a composição corporal e as medicações em uso (3).
A seguir, entenda quais as recomendações atuais relacionadas aos macronutrientes na nutrição parenteral em adultos, visando apoiar uma prescrição segura, individualizada e baseada em evidências.
Equilíbrio de macronutrientes na nutrição parenteral
Na nutrição parenteral existe um conceito chamado de “poder de três”. Ele se refere aos efeitos benéficos de criar uma dieta que combine todos os macronutrientes: proteínas, carboidratos e lipídios. Essa associação tem o potencial de gerar melhores resultados no estado clínico dos pacientes que recebem a nutrição endovenosa (4).
As principais vantagens da combinação dos três macronutrientes na nutrição parenteral incluem:
- Evitar hiperglicemia;
- Reduzir o estresse respiratório e metabólico (5);
- Garantir o fornecimento de ácidos graxos essenciais e aminoácidos essenciais (6);
- Reduzir o risco para hipofosfatemia (baixa concentração plasmática de fosfato, que pode levar a complicações) (7);
- Facilitar a infusão periférica devido à baixa osmolaridade (8);
- Transmitir efeito favorável sobre a função das células do fígado e integridade com nova geração de emulsões lipídicas (9, 10).
Embora todos os macronutrientes sejam fundamentais, a proteína pode requerer uma atenção especial. Isso porque o adoecimento e a internação hospitalar são riscos importantes para a desnutrição, que pode provocar perda de massa muscular, agravando o estado geral de saúde do paciente (11).
Entretanto, a reposição de proteínas não costuma ser feita de forma isolada. Geralmente, os carboidratos são as principais fontes de energia, e equivalem de 50% a 60% do valor energético total da dieta segundo as Recomendações Nutricionais para Adultos em Terapia Nutricional Enteral e Parenteral. Já os lipídios respondem por 20% a 35%, e as proteínas equivalem a uma fatia entre 10% e 15% (12).
Essas proporções podem ser modificadas de acordo com o quadro de cada paciente. Além disso, um tratamento com nutrição parenteral completo deve incluir a adição de micronutrientes (12).
Adiante, conheça o papel de cada macronutriente na nutrição parenteral.
Proteínas
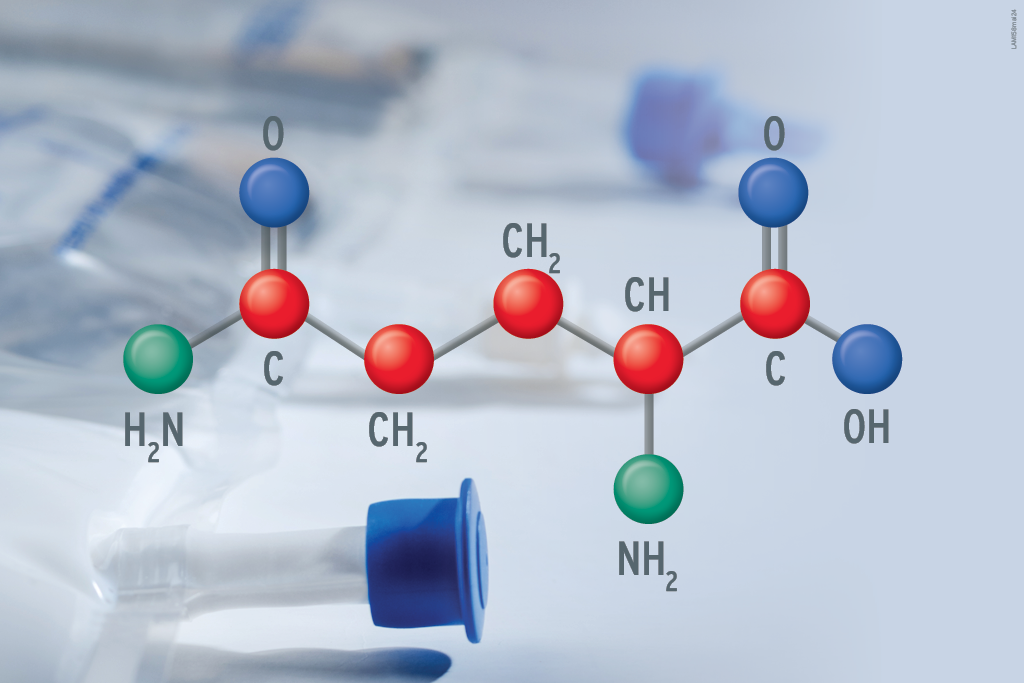
As proteínas são formadas por longas cadeias de aminoácidos. Na alimentação parenteral, elas são fornecidas sob a forma de aminoácidos livres ou dipeptídeos. A solução de aminoácidos é um componente indispensável na NP, pois sua ausência afeta diretamente a homeostase do balanço nitrogenado do paciente (3).
Um fornecimento adequado de proteína é essencial para manter a integridade e a função celular. Algumas das funções que esse macronutriente exerce no organismo são:
- Componente estrutural e funcional de todos os tecidos corporais;
- Processos essenciais do corpo, tais como equilíbrio da água, nutrientes e transporte de oxigênio (hemoglobina, transferrina, albumina sérica);
- Fonte de energia (4 kcal/g);
- Produção de glicose (aminoácidos glicogênicos) e gordura (aminoácidos cetogênicos).
Em um adulto com metabolismo normal, a necessidade proteica esperada é de 0,8 g/kg/dia para manter funções corporais saudáveis. Em situações de estresse catabólico, essa necessidade pode aumentar, variando de 1,2 a 1,5 g/kg/dia ou até 2,0 a 2,5 g/kg/dia em casos excepcionais, como em pacientes com obesidade ou queimaduras graves (3).
Alguns aminoácidos são especialmente importantes quando há presença de determinadas situações clínicas:
- Cisteína – Em casos de doença hepática;
- Glutamina – Quando há infecção, inflamação e outros tipos de estresse catabólico, desnutrição;
- Taurina – Estresse catabólico e uremia;
- Tirosina – Insuficiência renal crônica.
Em muitas doenças agudas e crônicas associadas ao estresse catabólico, a degradação de proteína corporal é acelerada para fornecer aminoácidos e para cobrir as necessidades de gliconeogênese, síntese de proteínas de fase aguda, cicatrização de feridas e fornecimento de glutamina (13).
Embora soluções padrão de aminoácidos (10% a 20%) sejam amplamente utilizadas, elas podem ser inadequadas em pacientes com distúrbios metabólicos específicos, doenças hepáticas ou renais graves, sendo necessária a personalização da fórmula (3).
Carboidratos
No corpo humano, a glicose é a principal fonte de energia em circulação, assim como um componente chave da NP. Na realidade, a glicose representa a principal fonte de carboidratos nesse tipo de dieta, pois outras opções como frutose, sorbitol e xilitol podem produzir efeitos colaterais negativos (3).
A glicose é administrada por via intravenosa, geralmente como glicose monoidratada (3,4 kcal/g) ou anidra (3,85 kcal/g), sendo a fonte mais comum de carboidrato na NP. As soluções comerciais variam de 5% a 70%, e sua escolha depende do volume necessário, do estado hemodinâmico do paciente e da via de administração – periférica ou central (3).
Em geral, 60% da energia não proteica deve vir dos carboidratos, com uma taxa de infusão preferencial entre 3,0 a 3,5 g/kg/dia (2,1–2,4 mg/kg/min), respeitando limite superior de 4 g/kg/dia (2,8 mg/kg/min) (3).
Veja a importância da função metabólica da glicose:
- É o principal combustível para todas as células do corpo humano;
- Células vermelhas do sangue e células tubulares dependem de glicose para a produção de energia;
- Fonte de energia primordial do cérebro;
- Armazenada como glicogênio no fígado e músculo esquelético (14).
As reservas hepáticas de glicogênio são suficientes para atender às necessidades de glicose por até 24 horas de jejum, e as reservas estocadas no músculo são utilizadas localmente para fornecimento de energia na contração muscular.
Após o esgotamento, a glicose é sintetizada endogenamente, principalmente, a partir de aminoácidos através da gliconeogênese hepática. Porém, a capacidade máxima de produção de glicose hepática, que normalmente é de 3,6 a 4,3 g/kg de peso corporal/dia em adultos saudáveis, pode ser aumentada durante doenças agudas.
Portanto, o fornecimento adequado de glicose é fundamental para evitar o desperdício de aminoácidos como substrato para a gliconeogênese e, assim, preservar a proteína corporal e a massa muscular (13).
Hiperglicemia
Assim como a escassez é prejudicial, o excesso de glicose é perigoso, uma vez que a capacidade máxima de oxidação desse nutriente no organismo é limitada.
O excesso de glicose é convertido em ácidos graxos e armazenado no tecido adiposo ou no fígado. Além disso, sua oxidação está associada a uma produção elevada de gás carbônico, o que pode levar a estresse respiratório – especialmente prejudicial em pacientes com disfunções respiratórias obstrutivas ou restritivas (14, 15).
Durante doenças críticas e traumas, é comum ocorrer hiperglicemia induzida por estresse. Isso acontece porque hormônios, citocinas e sinais neurológicos aumentam a produção hepática de glicose e provocam resistência periférica à insulina, tornando o controle glicêmico mais difícil (16).
Dessa forma, recomenda-se iniciar a NP com baixas doses de glicose (1–2 g/kg/dia) em pacientes hipercatabólicos, com sepse, diabetes, uso de corticosteroides ou em idosos, sempre com rigoroso monitoramento da glicemia capilar e ajuste da insulina conforme necessário (3).
Se a glicemia persistir acima de 200 mg/dL e forem necessárias altas doses de insulina (>6 UI/h), pode ser necessário reduzir a dose de glicose. (3).
Lipídios
Com uma densidade energética de aproximadamente 9 kcal/g, os lipídios são importantes substratos energéticos e a principal forma de armazenamento de energia no corpo humano.
Na nutrição parenteral, são fornecidos em emulsões com osmolaridade e pH próximos ao fisiológico, contribuindo para o controle glicêmico e prevenção da esteatose hepática. Além disso, suprem a necessidade de ácidos graxos essenciais e têm efeito modulador da resposta inflamatória (15-22).
Tradicionalmente, o óleo de soja é utilizado como fonte lipídica, mas hoje há opções mais balanceadas, com óleo de oliva, triglicerídeos de cadeia média e óleo de peixe (4). Os triglicerídeos são os principais componentes dessas emulsões e suas propriedades variam conforme o tipo de ácido graxo — saturados, monoinsaturados ou poli-insaturados — influenciando aspectos como fluidez de membrana e atividade inflamatória (3).
Entre os benefícios clínicos dos lipídios, destacam-se:
- Redução da osmolaridade das soluções, especialmente útil em infusões periféricas;
- Alternativa energética para pacientes com restrição de volume ou intolerância à glicose;
- Fonte essencial de energia em condições catabólicas (15-22).
A infusão lipídica é recomendada em PN prolongada (≥14 dias em adultos). É fundamental monitorar os níveis séricos de triglicerídeos: deve-se suspender a infusão se excederem 1000 mg/dL, e ajustar a dose em esquemas contínuos se ultrapassarem 400 mg/dL (C). As doses habituais variam de 0,5 a 1,0 g/kg/dia em adultos (3).
A hiperlipidemia é uma limitação frequente ao uso de lipídios na NP. Nesses casos, preferem-se emulsões com baixa relação fosfolipídeo/triglicerídeo, como as de 20%, pois as emulsões a 10% apresentam maior carga de fosfolipídeos, o que pode piorar o perfil lipêmico (3).
Além disso, embora o mecanismo exato da lesão hepática por lipídios ainda não esteja claro, sabe-se que a infusão de emulsão lipídica pode ser complicada pela síndrome de sobrecarga lipídica. Colestase, trombocitopenia, hipóxia e coagulação intravascular disseminada são os sintomas descritos da síndrome. Ela ocorre após o fornecimento de ácidos graxos em quantidades superiores a 3,0 g/kg/dia (23).
Conclusão
A nutrição parenteral é uma estratégia essencial e complexa, especialmente indicada quando a via oral ou enteral não é viável. A adequada combinação e monitoramento dos macronutrientes — proteínas, carboidratos e lipídios — são fundamentais para garantir um aporte nutricional completo, minimizar riscos metabólicos e promover melhores desfechos clínicos.
No entanto, esse processo exige individualização cuidadosa, pois as necessidades nutricionais variam conforme fatores como estado clínico, idade, composição corporal e uso de medicamentos. Por isso, a prescrição e o acompanhamento da NP devem ser feitos por uma equipe especializada, com base em diretrizes atualizadas e na resposta clínica de cada paciente.
Referências
1 – Verlato G, Meneghelli M, Cavicchiolo ME. Macronutrients and Micronutrients in Parenteral Nutrition. Nutrients. 2024 Dec 27;17(1):46.
2 – Baker M, French C, Hann M, Lal S, Burden S. A scoping review of parenteral requirements (macronutrients, fluid, electrolytes and micronutrients) in adults with chronic intestinal failure receiving home parenteral nutrition. J Hum Nutr Diet. 2024 Jun;37(3):788-803.
3 – Boemer HT. Parenteral nutrition: how to prescribe your inputs. Int J Nutrol. 2022;15(2).
4 – Waitzberg DL, et al. Parenteral lipid emulsions and phagocytic systems. Br J Nutr. 2002;87 Suppl 1:49-57.
5 – Roulet M, et al. A controlled trial of the effect of parenteral nutritional support on patients with respiratory failure and sepsis. Clin Nutr. 1983;2:97-105.
6 – Carpentier Y, Sobotka L. Lipids. In: Sobotka L, editor. Basics in Clinical Nutrition. Prague: Galen; 2011. p. 257-262.
7 – Tovey SJ, Benton KG, Lee HA. Hypophosphataemia and phosphorus requirements during intravenous nutrition. Postgrad Med. 1977;53:289-297.
8 – Pineault M, et al. Beneficial effect of coinfusing a lipid emulsion on venous patency. JPEN. 1989;13:647-640.
9 – Piper SN, et al. Hepatocellular integrity after parenteral nutrition: comparison of a fish-oil-containing lipid emulsion with an olive-soybean oil-based lipid emulsion. Eur J Anaesthesiol. 2009;26:1076-1082.
10 – Antebi H, et al. Liver function and plasma antioxidant status in intensive care unit patients requiring total parenteral nutrition: comparison of 2 fat emulsions. JPEN J Parenter Enteral Nutr. 2004;28:142-148.
11 – Parra BFC, et al. SARCPRO: Proposta de protocolo para sarcopenia em pacientes internados. BRASPEN J. 2019;34(1):58-63.
12 – Sociedade Brasileira de Nutrição Parenteral e Enteral, Sociedade Brasileira de Clínica Médica, Associação Brasileira de Nutrologia. Recomendações Nutricionais para Adultos em Terapia Nutricional Enteral e Parenteral. 2011.
13 – Bolder U, et al. Carbohydrates – guidelines on parenteral nutrition, chapter 5. Ger Med Sci. 2009;7:Doc23.
14 – Carpentier Y, Sobotka L, Soeters P. Carbohydrates. In: Sobotka L, editor. Basics in Clinical Nutrition. Galen: 2011. p. 252-257.
15 – Askanazi J, et al. Nutrition for the patient with respiratory failure: glucose vs. fat. Anesthesiology. 1981;54:373-377.
16 – McCowen KC, Malhotra A, Bistrian BR. Stress-induced hyperglycemia. Crit Care Clin. 2001;17:107-124.
17 – Koletzko B, et al. Guidelines on Paediatric Parenteral Nutrition of the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the European Society for Clinical Nutrition and Metabolism (ESPEN), supported by the European Society of Paediatric Research (ESPR). J Pediatr Gastroenterol Nutr. 2005;41 Suppl 2:1-87.
18 – Adolph M, et al. Lipid emulsions – guidelines on parenteral nutrition, chapter 6. Ger Med Sci. 2009;7:Doc22.
19 – Carpentier Y, Sobotka L. Lipids. In: Sobotka L, editor. Basics in Clinical Nutrition. Prague: Galen; 2011. p. 257-262.
20 – Grimble RF. Fatty acid profile of modern lipid emulsions: Scientific considerations for creating the ideal composition. Clin Nutr Suppl. 2005;1:9-15.
21 – Wanten GJ, Calder PC. Immune modulation by parenteral lipid emulsions. Am J Clin Nutr. 2007;85:1171-1184.
22 – Elmadfa I, Kornsteiner MF. Fats and fatty acid requirements for adults. Ann Nutr Metab. 2009;55:56-75.
23 – Żalikowska-Gardocka M, Przybyłkowski A. Review of parenteral nutrition-associated liver disease. Clin Exp Hepatol. 2020 Jun;6(2):65-73